Dies ist eine alte Version des Dokuments!
Inhaltsverzeichnis
Die Stirling-Maschine
Worum geht es in diesem Kapitel?
 Wir wollen hier eine Wärmekraftmaschine in ihrer prinzipiellen Funktion behandeln. Eine Wärmekraftmaschine ist eine Maschine, die (zumindest einen Teil) der Wärme aus einem Wärmereservoir in mechanische Arbeit verwandelt. Das geht, wie die hier behandelte Maschine konkret beweist.
Wir wollen hier eine Wärmekraftmaschine in ihrer prinzipiellen Funktion behandeln. Eine Wärmekraftmaschine ist eine Maschine, die (zumindest einen Teil) der Wärme aus einem Wärmereservoir in mechanische Arbeit verwandelt. Das geht, wie die hier behandelte Maschine konkret beweist.
Damit werden wir schon einen ersten Nutzen aus dem Kapitel gezogen haben: Das ist der grundsätzlichen Aufbau eines Wärmekraftwerks.
Diese Maschine (ein thermodynamisches System) entnimmt Wärme aus einem Reservoir mit hoher Temperatur $T_h$ 1). Die Erfahrung hat immer wieder bestätigt, dass für eine solche Wärmentnahme noch ein zweites Reservoir mit einer kühleren Temperatur $T_c$ gebraucht wird2), an das die Maschine regelmäßig den ganzen Rest der im heißen System abgeholten Wärme abgibt; eben den Rest, der nicht in Arbeit umgewandelt wird. Das kann sogar mit den Kenntnissen, die wir bereits haben, verstanden werden: Erst dann, wenn es ein zweites System mit einer niedrigeren Temperatur gibt, kann Wärme überhaupt vom heißen System abfließen; von dem so „angelockten“ Wärmestrom kann auf raffinierte Art ein Teil in mechanische Arbeit umgewandelt werden - wie, werden wir gleich sehen. Damit haben wir eine weitere Erkenntnis:
Wärmekraftmaschinen brauchen neben einer Wärmequelle auch eine Wärmesenke3).
Das ist aber längst nicht alles, was wir mit dieser Maschine anfangen können: Es stellt sich nämlich heraus, dass jeder einzelne Ablauf beim Betrieb dieser Maschine (trotz des 2. Hauptsatzes!) auch in die umgekehrte Richtung laufen kann; diese Maschine ist, wie es in der Fachsprache heißt, reversibel. In dieser umgekehrten Richtung entnimmt die Maschine Wärme aus dem kälteren Reservoir4) und führt diese Wärme zusammen mit der aufgebrachten mechanischen Arbeit an das heiße Reservoir ab. Damit haben wir gleich zwei praktisch bedeutende Maschinen gewonnen:
Den Kühlschrank: dem kältere Reservoir kann aktiv Wärme entnommen werden, es wird gekühlt. Und…
Die Wärmepumpe; dem heißeren Reservoir wird aktiv Wärme zugeführt, die zu einem großen Teil aus dem kälteren Reservoir stammt, aber auch die aufgewendete Arbeit enthält.
Diese beiden alternativen Nutzungen der Stirling-Maschine machen jeweils etwas, das nach der einfachen Intuition 'unvorstellbar' erscheint - in einem heißen System aus einer kälteren Umgebung heraus Wärme abziehen! Auf den allerersten Blick scheint es sogar, dass das der als 2. Hauptsatz formulierten Erfahrung widerspreche. Hier zeigt sich ein weiteres mal, wie wichtig eine klare Formulierung der Sachverhalte ist: Der zweite Hauptsatz sagt nicht, dass die Wärmeentnahme aus einem kälteren System nicht möglich sei. Er sagt nur, dass ein solcher Vorgang „nicht von selbst“ stattfindet und dass es nicht das einzige Ergebnis eines Prozesses sein kann: In unserem Fall geschieht die Wärmeentnahme auch nicht „von selbst“ sondern technisch bewerkstelligt mit der Stirling-Maschine; und zu deren Betrieb als Wärmepumpe wird mechanische Energie benötigt - die von irgendwoher bereitgestellt werden muss; dort fehlt sie dann, das ist das weitere Ergebnis des Prozesses. Damit eignet sich der Stirling-Prozess (in beide Richtungen) zur Präzisierung dessen, welche physikalischen Bedingungen dafür gegeben sein müssen und welcher minimale Aufwand dafür erforderlich ist, ein kaltes System doch weiter zu kühlen.
Aus Sicht der physikalischen Erkenntnis ist die Kombination dieser umgekehrt herum laufenden Maschine mit der ursprünglichen Maschine hoch interessant: führen wir beide Prozesse nacheinander durch, so sind alle Systeme (die Wärmekraftmaschine, die Wärmepumpe und beide Reservoire) hinterher in genau dem gleichen Zustand wie am Anfang.
Der ideale Stirling-Prozess ist genau so ein reversibler Prozess, der den von Natur aus eigentlich „irreversiblen“ Wärmetransport von $T_h$ nach $T_c$ reversibel macht. Ideal durchgeführt, wird der Wärmetransport dadurch 'verlustfrei'. Es wird nämlich genau soviel mechanische Arbeit gewonnen5) wie wir hinterher wieder brauchen, um mit der gleichen Maschine im umgekehrten Ablauf die Wärme wieder zurück zu holen6). Das ist somit
Ein exzellentes Beispiel für sehr hohe (im Grenzfall ideale) Energieeffizienz.
Es ist zugleich ein Tool, mit dem
Grundlegende Fragen der Thermodynamik behandelt und am Ende sogar quantitative Aussagen dazu hergeleitet werden können.
Wirklich, das ist eine ganze Schatztruhe, die wir damit erschließen. Das schönste daran aber ist:
Die hier beschriebene Maschine kann7) tatsächlich in der Praxis gebaut werden. Dies wird klar, wenn wir die Erklärung zum Aufbau und zum Betrieb des Stirlingmotors - wie unten dargestellt - betrachten.
Das Foto ganz oben zeigt z.B. einen Eigenbau einer Stirling-Maschine von Pedro Servera. Im Internet gibt es eine Reihe von Beschreibungen zu „wir bauen uns einen Stirling-Motor“, z.B. hier; 'Stirling Engine - Made In An Hour'. Oder, ein einfaches Demonstrationsmodell kann auch bestellt werden (suche nach „Stirlingmotor“; hier wird das Modell erklärt: Stirling-Modell).
Die Bestandteile der Stirling-Maschine
Wir behandeln hier zunächst die Motorfunktion der Maschine. Diese benötigt zum Betrieb zwei weitere Systeme: Ein Temperaturreservoir mit einer hohen Temperatur $T_h$ („heiß“) und ein Reservoir mit einer niedrigeren Temperatur $T_c$ („kalt“. bzw. „cool“). Diese Systeme heißen Reservoire, weil sie, 'egal was passiert', ihre Temperatur halten. Insbesondere auch dann, wenn ihnen Wärme zugeführt bzw. entnommen wird. Eine 'Vorstellung' dazu ist, sich deren Wärmekapazität als extrem groß (quasi-unendlich) zu denken, dann macht ein wenig entnommene Wärme an der Temperatur kaum etwas aus; es ist aber auch eine technologische Realisation möglich, indem von einem geregelten Wärmeerzeuger immer genau die Wärme wieder zugeführt wird, die gerade entnommen wurde. Das ist die Methode, die bei realen Kraftwerken regelmäßig realisiert ist8). | heißes (oben, rot) und kaltes Reservoir (blau) |
Zylinder | Arbeitsgas im Zylinder |
Arbeitskolben | Arbeitskolben |
Hier ist ein Beispiel für den Arbeitskolben bei der Arbeit: Die „isotherme Expansion“12) beim heißen Temperaturniveau ist im Gang. Der Kolben hat sich gegenüber der letzten Zeichnung so bewegt, dass das Volumen um d$V$ zugenommen hat.
Infobox: zugehörige Gleichungen. Kann auch übersprungen werden | Expansion leistet Arbeit |
Jetzt kommt der angekündigte Trick! Wie können wir das Gas zwischen dem heißen und dem kalten Teil verschieben? Dazu dient ein Verdrängungskolben, der gerade groß genug ist, den heißen Bereich (und auch, alternativ, den kalten Bereich) im Zylinder zu füllen. Setzen wir diesen Verdrängungskolben an der richtigen Stelle in den Zylinder ein, so bleibt dem Arbeitsgas keine andere Möglichkeit als das Volumen im nicht verdrängten Teil des Zylinders. Freilich muss das Gas dazu durchaus am Verdrängungskolben vorbei kommen - oder, durch ihn hindurch - dafür ist der Kanal in seiner Mitte eingezeichnet. Da strömt das Gas reibungsfrei hindurch14). Und, im Idealfall ist auch das Volumen im inneren dieses Kanals vernachlässigbar klein15). | Verdrängungskolben |
Der Verdrängungskolben lässt sich kräftefrei verschieben16). In der nebenstehenden Zeichnung wird der Verdrängungskolben nach oben (also in den heißen Bereich hinein) verschoben. Er verdrängt das heiße Gas dort, es strömt durch den Kanal im Kolben auf die kalte Seite. Und hier kommt ein genialer Trick: der Kanal ist mit feinkörnigem wärmespeicherndem Material 'gefüllt', natürlich so, dass das Gas da immer noch mechanisch weitgehend ungehindert hindurchkommt. Da das Material in der Temperatur vom Boden bis zum Dach des Zylinders in der Temperatur von der des unteren auf die des oberen Reservoirs zunimmt, kann das Arbeitsgas sich beim Durchströmen jeweils an die Temperatur der Seite, auf die es wechselt, anpassen. Ein solches Teilsystem nennt sich „Regenerativ-Wärmeübertrager r-WÜ“ oder einfach „Regenerator“; diese WÜ finden in der Praxis auch bei der Wärmerückgewinnung Einsatz. | Verdrängungskolben im Einsatz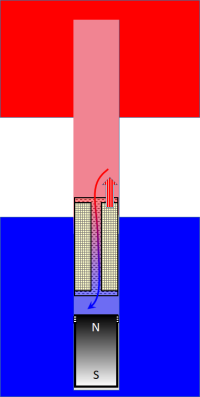 |
Der Prozess in Einzelschritten: Stirling-Maschine als Motor
Isotherme Expansion bei hoher Temperatur | Arbeitsprozess bei $T_h$ |
Diese dritte Spalte kann ein Leser, für den dies „neue Inhalte“ sind, beim ersten Lesen erstmal überspringen. Hier kommt die mathematische Formulierung der zuvor erklärten Sachverhalte. Die quantitativen Ergebnisse dieser Experimente sind natürlich ohne die zugehörigen Gleichungen nicht zu bekommen19) |
Hier ist allein der Verdrängungskolben in Aktion: Er verdrängt das Gas im aus dem heißen Raum (Teilprozess II). Besonderer Trick: Der Regenerator nimmt dabei die Wärme auf, die bei der Abkühlung des Arbeitsgases frei wird. Das Volumen bleibt hierbei konstant, die Fachleute nennen dies einen „isochoren“ Prozess22). Daher wird dabei auch keine Arbeit geleistet. | Verdrängung des Gases vom heißen in den kalten Raum 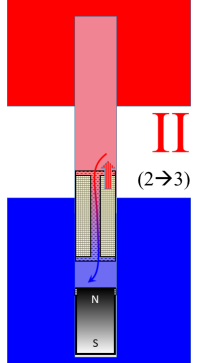 |
Ergänzung noch zum letzten Teilprozess: |
Jetzt ist das gesamte Arbeitsgas kalt und lässt sich (bei niedrigerem Gasdruck) leichter komprimieren. Dies erfolgt im Teilprozess III: Isotherme Kompression bei der niedrigen Temperatur. | Die Kompression kostet mechanische Arbeit; weil sie aber mit dem kalten Gas bei konstant $T_c$ durchgeführt wird, weniger Arbeit als zuvor bei der Expansion 'im heißen' geliefert wurde. 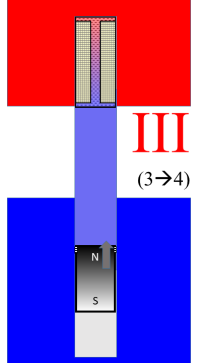 |
Für ein kleines Teilstück der Kompression d$V$ ist die Arbeit |
Nun haben wir vollständig komprimiertes Gas, es ist aber immer noch kalt. Jetzt schieben wir es einfach unter konstantem Volumen in den heißen Raum zurück (Teilprozess IV); das macht wieder der Verdrängungskolben, ohne Arbeitsaufwand. Zudem wird beim Strömen durch den mit dem Regenerator gefüllten Kanal das Arbeitsgas mit der vom letzten isochoren Prozess (II) gespeicherten Wärme auf die hohe Temperatur erwärmt. Die gespeicherte Wärmemenge passt gerade: Es ist die gleiche Masse an Gas und die betragsmäßig gleiche Temperaturdifferenz. | Verdrängungskolben in den kalten Maschinenteil verschoben: Das Gas entweicht in den heißen Raum, der Druck steigt entsprechend kontinuierlich an.  |
Im Teilprozess IV ist wieder das Volumen konstant, das Gas leistet daher keine Arbeit nach außen d$w_{IV}$=0. Es wird nun auf die Temperatur $T_h$ erwärmt; dabei nimmt es Wärme aus dem Regenerator auf: |
Der Prozess im Druck-Volumen-$(pV)$-Diagramm
Rechts dargestellt sind die Kurven der Wertepaare $(V, p)$ für das im Zylinder eingeschlossene Arbeitsgas, dargestellt in einem Koordinatensystem mit dem Volumen $V$ als horizontaler und dem Druck $p$ als vertikaler Achse. Ein ideales Gas kann im Prinzip alle denkbaren Kombinationen $(V, p)$ annehmen. Aufgrund der allgemeinen Gasgleichung ist aber, wenn wir sowohl $V$ als auch $p$ festlegen, die Temperatur des Gases $T$ bereits bestimmt, die gilt nämlich immer: | Das $pV$-Diagramm des Stirling-Motors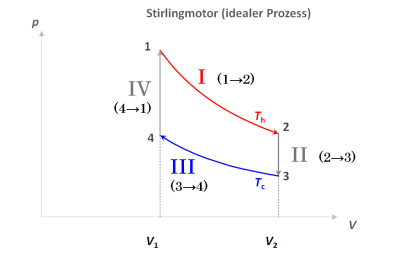 In den Lehrbüchern wird der Stirlingprozess oft anhand dieses $(p , V)$-Diagramms behandelt. Hier wird unmittelbar sichtbar, wie die Arbeitsdifferenz als Differenz der Flächen unter der oberen und der unteren Isotherme resultiert29). Die im Kreisprozess eingeschlossene Fläche charakterisiert die gesamte von der Maschine insgesamt abgegebene Arbeit. |
Animation: idealisierter Stirling-Prozess
Hier ist die gesamte Animation, wie diese Maschine im Grundprinzip funktioniert: |  Stirling Prozess |
Stirlingmotor - Was er macht
Da wir den vollen Zyklus jetzt beschrieben haben, können wir alle vier Einzelprozesse in Ihrer Abfolge betrachten und zusammenfassen:
Beginnen wir aus Sicht des heißen Temperaturreservoirs $T_h$: Das wird nur vom Teilprozess I angezapft und ihm wird dabei die Wärme $Q_I$ entnommen:
$Q_I=C_{Maschine}\cdot T_h .$
Das ist die Energiebereitstellung, welche für den Betrieb des Motors erfolgen muss („Input“ für ein Energieflussbild).
Dagegen wird das kalte Temperaturreservoir ausschließlich im Schritt III mit Wärme beschickt:
$Q_{III}=-C_{Maschine}\cdot T_c .$
das ist aus Kraftwerkssicht Verlustwärme. Weil sie genau auf der „Umgebungstemperatur“ $T_c$ abgeführt wird, kann damit niemand mehr etwas anfangen; es ist aus praktischer Sicht vollkommen entwertete Energie35) 36).
Der Nutzen der Maschine ist die in der Gesamtbilanz über den Zyklus abgegebene Arbeit, die wir zu
$w_{tot}=w_I + w_{III}= C_{Maschine} (T_h - T_c)$
bestimmt haben. Das ist der nutzbare „Output“ und damit lässt sich sofort der Wirkungsgrad dieses Motors bestimmen $\eta=\frac{Output}{Input}$:
$\eta=\frac{w_{tot}}{Q_I}=\frac{C_{Maschine} (T_h - T_c)}{C_{Maschine}\cdot T_h}$
Die maschinenspezifischen Eigenschaften kürzen sich heraus, es bleibt
${\displaystyle \eta=\frac{T_h - T_c}{T_h}}$
Das ist eine wohlbekannte Größe, nämlich der sogenannte Carnot-Wirkungsgrad, der 1824 erstmals von Nicolas Léonard Sadi Carnot mit dem auch nach ihm benannten Carnot-Prozess bestimmt wurde. Wie wir in der Folge noch sehen werden, hat dieser Wirkungsgrad eine fundamentale physikalische Bedeutung, völlig unabhängig von der speziellen Art von Maschine, mit der die Energieumwandlungen durchgeführt werden.
Wir zeigen ein paar Bespiele für die mit idealen reversiblen Maschinen erreichbaren Carnot-Wirkungsgrade. Dort wird auch gleich die Exergie als der „wertvolle Teil“ eines Energiestroms eingeführt.
Zurück zum Kapitel 2. Hauptsatz
Weiter zum Kapitel Stirlingwärmepumpe
Zurück zur Kursübersicht "Bauphysik"
Anhang zu einem Einwand: ideale und praktische Maschine
Hier gibt es dann oft einen 'prinzipiell' klingenden Einwand: Diese Kombimaschine aus einem idealen Stirlingmotor und einer idealen Stirling-Wärmepumpe wäre dann ein echtes Perpetuum mobile: Eine Maschine, die ohne sonstige Änderungen in der Natur dauernd von selbst läuft - und „eine solche darf es doch gar nicht geben.“ Wir lösen dies als Scheinwiderspruch im Folgenden auf:
- Zunächst einmal ist klar, dass auch diese ideale Kombimaschine keine freie Arbeit liefert. Sie läuft „nur“. Und weil selbst das Feststellen dieses 'Laufens' einen geringfügigen Energiebetrag erfordert, könnten wir, so es diese ideale Maschine ansonsten wirklich gäbe, diesen Zustand in der Praxis noch nicht einmal verifizieren.
- Schon aus dem ersten Punkt wird klar, dass es die ideale Kombimaschine eben in der Praxis dann doch nicht gibt; sie ist nur eine theoretisches Konstruktion, freilch eine sehr hilfreiche. Geringfügige „Schmutzeffekte“ gibt es eben immer, z.B. dass es bei einer Temperaturdifferenz von „Null“ zwischen dem heißen Reservoir und dem heißen Prozessabschnitt unendlich lange dauern würde, bis dabei überhaupt Wärme übertragen wird. Andersherum: Damit in endlicher Zeit Wärme übertragen wird, wird es immer eine, im Grundsatz auch „extrem kleine“ Temperaturdifferenz an dieser Stelle geben müssen; und genau dieser Teilprozess ist dann wieder wirklich irreversibel, d.h. eine in der Praxis realisierte Maschine wird den Wirkungsgrad der idealen Kombimaschine nie exakt erreichen, sondern ein wenig darunter bleiben. Das kann wiederum extrem wenig sein, d.h., auch die praktische Maschine könnte dem idealen Kombiprozess sehr nahe kommen - nur, diesen eben nicht exakt erreichen.
- Eine letzte Bemerkung aus der Anwendungspraxis dazu: Ob so ein Wirkungsgrad (z.B. des Stirlingmotors) im Einzelfall nun z.B. 48% tatsächlich erreicht oder doch nur 47,8% - das ist auch für die Praxis unbedeutend. Die heute tatsächlich vorliegenden Abstände zwischen dem ideal Möglichen und dem bisher Üblichen liegen eher bei Faktoren 1,5 bis 10. Die „2“ z.B. bei einem konkreten Kohlkraftwerk, die „10“ bei den Wärmeverlusten eines beheizten Gebäudes. Da gibt es somit einen enormen Spielraum - auch wenn „exakt ideal“ nicht erreichbar ist.</WRAP>
